| assalamualeikum - Segundo Bimestre |
|
|
|
|
- EL AGUA Y SU IMPORTANCIA
A- PROPIEDADES FÍSICAS DEL AGUA
A.1- APARIENCIA
A.2- DENSIDAD
B- LA ESTRUCTURA DE LA MOLÉCULA DE AGUA
C- POLARDAD DEL AGUA
D- ENLACE POR PUENTE DE HIDRÓGENO
E- REACCIONES IMPORTANTES EN LAS QUE SE PRODUCE AGUA
E.1- COMBUSTIÓN
E.2- COMBINACIÓN DE HIDRÓGENO Y IXÍGENO
E.3- PRODUCTO DE LA REACCIONES DE NEUTRALIZACIÓN
F- REACCIONES DEL AGUA
F.1- HIDRÓLISIS
F.2- REACCIONES CON CIETOS METALES
G- HIDRATOS
G.1- SUSTANCIAS EFLORESCENTES
G.2- SUSTANCIAS HIGROSCÓPICAS
G.3- SUSTANCIAS DELICUESCENTES
H- PURIFICACIÓN DEL AGUA
I- PERÓXIDO DE HIDRÓGENO
I.1- ESTRUCTURA
I.2-PREPARACIÓN
I.3- PROPIEDADES
I.4- USOS
II- DISOLUCIONES Y COLOIDES
A- FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN
A.1- LAS PROPIEDADES DEL SOLUTO Y DEL DISOLVENTE
A.2- LA TEMPERATURA
A.3- LA PRESIÓN
A.4- TAMAÑO D PARTÍCULA
A.5- VELOCIDAD DE AGITACIÓN
B- TIPOS DE DISOLUCIONES DE ACUERDO AL ESTADO FÍSICO DEL SOLUTO
B.1- GAS EN LÍQUIDO
B.2- UN LÍQUIDO EN LÍQUIDO
AB.3- SÓIDO EN LÍQUIDO
C- TIPOS DE DISOLUCIONES DE ACUERDO A LA CANTIDAD DEL SOLUTO PRESENTE
C.1- DISOLUCIONES SATURADAS
C.2- DISOLUCIONES NO SATURADAS
C.3 DISOLUCIONES SOBRESATUADAS
D- CONCENTRACIÓN DE LAS DISOLUCIONES
D.1- PORCENTAJE REFERIDO A LA MASA
D.2- PARTES POR MILLÓN
D.3- MOLARIDAD
D.4- NORMALIDAD
D.4.1- RELCIÓN DE MOLARIDAD A NORMALIDAD (FACTOR DE CONVERSIÓN)
D.5- MOLALIDAD
E- PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES
E.1- ELEVACIÓN DEL PUNTO DE EBULLICIÓN
E.2- ABATIMIENTO DEL PUNTO DE CONGELACIÓN
E.3- DETERMINACIÓN DE LA MASA MOLAR Y LA MASA MOLECULAR
III- COLOIDES Y SUSPENSIONES
A- EFECTO ÓPTICO
B- EFECTO DE MOVIMIENTO
C- EFECTO DE CARGA ELÉCTRICA
D- EFECTO DE ABSORCIÓN
IV- ÁCIDOS, BASES Y ECUACIONES IÓNICAS
A- PROPIEDADES Y DEFINICIÓN DE ÁCIDOS Y BASES
A.1- DEFINICIÓN DE ARRHENIUS
A.2- DEFINICIÓNN DE BRONSTED- LOWRY
A.3- DEFINICIÓN DE LEWIS
B- FUERZA DE LOS ÁCIDOS Y BASES
B.1- ELECTROLITOS FUERTES Y DÉBILES
B.2- FORMACIÓN DE IONES EN DISOLUCIONES ACUOSAS
B.2.1- IONIZACIÓN DEL AGUA
C- DISOCIACIÓN Y IONIZACIÓN
D- REACCIONES DE ÁCIDOS Y BASES
D.1- REACCIÓN DE ÁCIDOS CON LOS METALES
D.2- REACCIONES DE BASES PARA FORMAR COMPUESTOS INSOLUBLES
D.3- REACCIONES DE NEUTRALIZACIÓN Y TITULACIONES
V- EQUILIBRIO QUÍMICO E IÓNICO
A- DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO QUÍMICO E IÓNICO
B- DETERMINACIÓN DE LA CONSTANTE DE VELOCIDAD DE UNA REACCIÓN EN EQUILIBRIO
C- PRODUCTO DE SOLUBILIDAD.
A- PROPIEDADES FÍSICAS DEL AGUA
1) Estado físico: sólida, liquida y gaseosa
2) Color: incolora
3) Sabor: insípida
4) Olor: inodoro
5) Densidad: 1 g./c.c. a 4°C
6) Punto de congelación: 0°C
7) Punto de ebullición: 100°C
8) Presión critica: 217,5 atm.
9) Temperatura critica: 374°C
El agua químicamente pura es un liquido inodoro e insípido; incoloro y transparente en capas de poco espesor, toma color azul cuando se mira a través de espesores de seis y ocho metros, porque absorbe las radiaciones rojas. Sus constantes físicas sirvieron para marcar los puntos de referencia de la escala termométrica Centígrada. A la presión atmosférica de 760 milímetros el agua hierve a temperatura de 100°C y el punto de ebullición se eleva a 374°, que es la temperatura critica a que corresponde la presión de 217,5 atmósferas; en todo caso el calor de vaporización del agua asciende a 539 calorías/gramo a 100°.
Mientras que el hielo funde en cuanto se calienta por encima de su punto de fusión, el agua liquida se mantiene sin solidificarse algunos grados por debajo de la temperatura de cristalización (agua subenfriada) y puede conservarse liquida a –20° en tubos capilares o en condiciones extraordinarias de reposo. La solidificación del agua va acompañada de desprendimiento de 79,4 calorías por cada gramo de agua que se solidifica. Cristaliza en el sistemahexagonal y adopta formas diferentes, según las condiciones de cristalización.
A consecuencia de su elevado calor especifico y de la gran cantidad de calor que pone en juego cuando cambia su estado, el agua obra de excelente regulador de temperatura en la superficie de la Tierra y más en las regiones marinas.
El agua se comporta anormalmente; su presión de vapor crece con rapidez a medida que la temperatura se eleva y su volumen ofrece la particularidad de ser mínimo a la de 4°. A dicha temperatura la densidad del agua es máxima, y se ha tomado por unidad. A partir de 4° no sólo se dilata cuando la temperatura se eleva,. sino también cuando se enfría hasta 0°: a esta temperatura su densidad es 0,99980 y al congelarse desciende bruscamente hacia 0,9168, que es la densidad del hielo a 0°, lo que significa que en la cristalización su volumen aumenta en un 9 por 100.
Las propiedades físicas del agua se atribuyen principalmente a los enlaces por puente de hidrógeno, los cuales se presentan en mayor número en el agua sólida, en la red cristalina cada átomo de la molécula de agua está rodeado tetraédricamente por cuatro átomos de hidrógeno de otras tantas moléculas de agua y así sucesivamente es como se conforma su estructura. Cuando el agua sólida (hielo) se funde la estructura tetraédrica se destruye y la densidad del agua líquida es mayor que la del agua sólida debido a que sus moléculas quedan más cerca entre sí, pero sigue habiendo enlaces por puente de hidrógeno entre las moléculas del agua líquida. Cuando se calienta agua sólida, que se encuentra por debajo de la temperatura de fusión, a medida que se incrementa la temperatura por encima de la temperatura de fusión se debilita el enlace por puente de hidrógeno y la densidad aumenta más hasta llegar a un valor máximo a la temperatura de 3.98ºC y una presión de una atmósfera. A temperaturas mayores de 3.98 ºC la densidad del agua líquida disminuye con el aumento de la temperatura de la misma manera que ocurre con los otros líquidos.
A.1- APARIENCIA
El agua (del latín aqua) es una sustancia cuya molécula está formada por dos átomos de hidrógeno y uno de oxígeno (H2O). Es esencial para la supervivencia de todas las formas conocidas de vida. En su uso más común, con agua nos referimos a la sustancia en su estado líquido, pero la misma puede hallarse en su forma sólida llamada hielo, y en forma gaseosa que llamamosvapor. El agua cubre el 71% de la superficie de la corteza terrestre.2 En nuestro planeta, se localiza principalmente en los océanosdonde se concentra el 96,5% del agua total, los glaciares y casquetes polares tiene el 1,74%, los depósitos subterráneos en (acuíferos), los permafrost y los glaciares continentales suponen el 1,72% y el restante 0,04% se reparte en orden decreciente entre lagos, la humedad del suelo, atmósfera, embalses, ríos y seres vivos.3 Contrario a la creencia popular, el agua es un elemento bastante común en nuestro sistema solar y esto cada vez se confirma con nuevos descubrimientos. Podemos encontrar agua principalmente en forma de hielo; de hecho, es el material base de los cometas, y el vapor compone la cola de ellos.
Desde el punto de vista físico, el agua circula constantemente en un ciclo de evaporación o transpiración (evapotranspiración),precipitación, y desplazamiento hacia el mar. Los vientos transportan tanto vapor de agua como el que se vierte en los mares mediante su curso sobre la tierra, en una cantidad aproximada de 45.000 km³ al año. En tierra firme, la evaporación y transpiración contribuyen con 74.000 km³ anuales a causar precipitaciones de 119.000 km³ al año.4
Se estima que aproximadamente el 70% del agua dulce se consume en la agricultura.5 El agua en la industria absorbe una media del 20% del consumo mundial, empleándose como medio en la refrigeración, el transporte y como disolvente de una gran variedad de sustancias químicas. El consumo doméstico absorbe del orden del 10% restante.6
El agua potable es esencial para todas las formas de vida, incluida la humana. El acceso al agua potable se ha incrementado sustancialmente durante las últimas décadas en la práctica totalidad de la superficie terrestre.7 8 Sin embargo estudios de la FAO, estiman que uno de cada cinco países en vías de desarrollo tendrá problemas de escasez de agua antes del 2030; en esos países es urgente un menor gasto de agua en la agricultura modernizando los sistemas de riego.6
A.2- DENSIDAD
El agua líquida es más densa que el hielo a presión y temperatura estándar. Existe un cambio positivo en el volumen después del congelamiento, lo que ocasiona que el hielo flote. Si el hielo no flotara, la vida acuática en cuerpos de agua como lagos y en los polos terrestres, no existiría pues estos cuerpos de agua se congelarían desde el fondo hacia la superficie, de hecho, lo contrario, la capa de hielo que se forma sobre estos cuerpos de agua, resulta en un aislante térmico
B-LA ESTRUCTURA DE LA MOLÉCULA DE AGUA
Estructuralmente, la moléculas de agua está constituida por 2 átomos de hidrógeno y uno de oxigeno. El en lace entre esto átomos es covalente polar (presentan dos polos: + y -), pues cada átomo de Hidrógeno tiene necesidad de compartir un electrón y el de oxígeno do electrones, formando enlaces covalentes entre los átomos, y siendo polar porque el átomo más electronegativo atrae el par electrónico con más fuerza y queda desplazado hacia él; se produce así una cierta asimetría en la distribución d las cargas.
C- POLARDAD DEL AGUA
La polaridad de la molécula de agua no sólo es consecuencia de su geometría tetraédrica irregular, sino que también de la naturaleza de sus átomos: hidrógeno, el átomo más pequeño de la Química, y oxígeno, un átomo pequeño, pero principalmente de alta electronegatividad. Este término denota a los átomos que presentan gran capacidad de atraer electrones de enlace hacia sí. Por lo tanto, el átomo de oxígeno de la molécula de agua atrae hacia sí los electrones de los enlaces covalentes con los hidrógenos; hecho que da lugar a una polaridad de enlace.
D- ENLACE POR PUENTE DE HIDRÓGENO
Un enlace de hidrógeno es la fuerza atractiva entre un átomo electronegativo y un átomo de hidrógeno unido covalentemente a otro átomo electronegativo. Resulta de la formación de una fuerza dipolo-dipolo con un átomo de hidrógeno unido a un átomo denitrógeno, oxígeno o flúor (de ahí el nombre de "enlace de hidrógeno", que no debe confundirse con un enlace covalente a átomos de hidrógeno). La energía de un enlace de hidrógeno (típicamente de 5 a 30 kJ/mol) es comparable a la de los enlaces covalentes débiles (155 kJ/mol), y un enlace covalente típico es sólo 20 veces más fuerte que un enlace de hidrógeno intermolecular. Estos enlaces pueden ocurrir entre moléculas (intermolecularidad), o entre diferentes partes de una misma molécula (intramolecularidad).2 El enlace de hidrógeno es una fuerza de van der Waals dipolo-dipolo fija muy fuerte, pero más débil que elenlace covalente o el enlace iónico. El enlace de hidrógeno está en algún lugar intermedio entre un enlace covalente y una simple atracción electrostática intermolecular. Este tipo de enlace ocurre tanto en moléculas inorgánicas tales como el agua, y enmoléculas orgánicas como el ADN.
El enlace de hidrógeno intermolecular es responsable del punto de ebullición alto del agua (100°C). Esto es debido al fuerte enlace de hidrógeno, en contraste a los otros hidruros de calcógenos. El enlace de hidrógeno intramolecular es responsable parcialmente de la estructura secundaria, estructura terciaria y estructura cuaternaria de las proteínas y ácidos nucleicos.
E- REACCIONES IMPORTANTES EN LAS QUE SE PRODUCE AGUA
PROCESO DE SOLUBILIDAD
El agua es un solvente de gran cantidad de sales inorgánicas, de compuestos orgánicos y de gases. Es la fase dispersante en el estado coloidal de la célula y la fase dispersa la forman las proteínas solubles en agua.
No se conoce a la fecha otro compuesto como el agua que posea estas propiedades a la vez. Por ejemplo, el dimetilsulfóxido posee una constante dieléctrica grande y es una buena base de Lewis pero no forma puentes de hidrógeno; el fluoruro de hidrógeno (ácido fluorhídrico) tiene una constante dieléctrica grande y forma puentes de hidrógeno pero no es buena base de Lewis; y amoníaco gaseoso es buena base de Lewis y forma puentes de hidrógeno pero no tiene una constante dieléctrica grande.
Cuando se disuelve un sólido o un líquido las unidades estructurales (iones o moléculas) se separan una de otra y el espacio entre ellas es ocupado por una molécula del solvente. Durante el proceso es necesario suministrar energía para vencer las fuerzas interiónicas o intermoleculares, la que es aportada por la formación de uniones entre partículas del soluto y moléculas del solvente.
Solamente el agua y solventes muy polares pueden disolver en cantidad apreciable compuestos iónicos, que debido a las atracciones electrostáticas forman enlaces ion-dipolo, los cuales aportan energía suficiente para vencer las fuerzas interiónicas en el cristal. En el proceso de disolución cada ion es rodeado por muchas moléculas del solvente (solvatación). Además un solvente para que pueda disolver a los compuestos iónicos necesita tener una constante dieléctrica muy grande, es decir, que debe tener propiedades muy aislantes para disminuir la atracción entre los iones de carga opuesta una vez que se encuentren solvatados.
El agua es un solvente muy importante de compuestos iónicos debido a su polaridad, a su elevada constante dieléctrica y a que su grupo -OH le permite formar puentes de hidrógeno. Es capaz de solvatar tanto cationes (iones con carga positiva) en su polo negativo (esencialmente sus electrones no compartidos) como aniones (iones con carga negativa) por medio de puentes de hidrógeno.
Cuando se quiere preparar una solución, es obvio que en general se busca un solvente apropiado a la naturaleza del soluto y al efecto de la temperatura sobre la solubilidad del soluto, y los demás factores que tienden a complicar al fenómeno de disolución como la solvolisis en la que las moléculas del soluto separan a las moléculas del solvente, que complican aún más la selección del solvente (solvolisis, con el agua es hidrólisis; con el amoníaco es amonolisis).
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitavivamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema, es decir, de la tendencia del sistema a alcanzar el valor máximo de entropía.
Al proceso de interacción entre las moléculas del disolvente y las partículas del soluto para formar agregados se le llama solvatación y si el solvente es agua, hidratación.
NATURALEZA DEL SOLVENTE. La solubilidad de una sustancia es mayor cuando las moléculas del soluto son semejantes eléctrica y estructuralmente a las del solvente. Por eso se dice que “lo semejante disuelve a lo semejante”. Si existe semejanza entre las propiedades eléctricas (momento dipolar grande) entre el soluto y el solvente, las atracciones entre sus moléculas son fuertes y en caso contrario son débiles. Por eso un compuesto polar como el agua es un buen solvente de otro también polar como el alcohol, y mal solvente de una sustancia no polar como la gasolina. El benceno es un buen solvente de la gasolina porque es una molécula no polar.
En general, los solventes polares disuelven mejor a los compuestos iónicos que los solventes no polares. Por lo que, cuanto mayor sea la polaridad del disolvente mayor será la solubilidad en él de un compuesto iónico.
NATURALEZA DEL SOLUTO. Las interacciones soluto-solvente y soluto-soluto dependen del tipo de soluto y del tipo de solvente. Por ejemplo, a 20 ºC la solubilidad del cloruro de sodio (NaCl, 58.45 g/mol) es de 36 g/100 mL de agua y la del azúcar (sacarosa, C12H22O11, 342.3 g/mol) de 203.9 g/100 mL de agua. Con la solubilidad expresada en g de soluto/100 mL de solvente parece contradictorio porque el azúcar no es un compuesto iónico y parece tener una mayor solubilidad que el cloruro de sodio. Para obtener conclusiones válidas al comparar la solubilidad de las sustancias conviene usar la concentración molar (M = moles de soluto/litro de solución). Entonces para el cloruro de sodio se tiene que la concentración es de 6.15 M y para la sacarosa de 5.96 M, lo que resulta lógico porque hay mayor atracción entre los iones Na1+ y Cl1- y las moléculas polares del agua que entre las moléculas no polares de la sacarosa y las moléculas polares del agua.
En la interacción soluto-soluto, sin mucho rigor se puede decir, que un soluto influye muy poco sobre la solubilidad de otras sustancias diferentes en la misma solución, a menos que su concentración sea muy elevada o que tengan un ion común los solutos.
TEMPERATURA. El efecto de la temperatura sobre la solubilidad de sólidos, líquidos y gases no tiene una regla general. Entre los gases la solubilidad es muy grande, sin embargo, la solubilidad de los gases en el agua suele disminuir al aumentar la temperatura de la solución, pero en solventes distintos del agua la solubilidad de los gases no disminuye con el aumento de la temperastura.
La solubilidad de sólidos y líquidos tampoco sigue una regla general, por ejemplo, a medida que aumenta la temperatura el carbonato de litio (Li2CO3) es menos soluble en agua, el nitrato de plata (AgNO3) es más soluble y en el cloruro de sodio casi no cambia.
La variación de la solubilidad con la temperatura está relacionada con el calor de solución de cada sustancia y con el principio de Le Chatelier o sea con el calor desprendido o absorbido cuando la sustancia se disuelve hasta saturación. Si el proceso de disolución libera calor entonces el aumento de temperatura no favorece la disolución y sí cuando lo absorbe (calor negativo).
PRESIÓN. El efecto sobre la solubilidad en sólidos y líquidos prácticamente no influye, sin embargo, la solubilidad de todos los gases aumenta con el incremento de presión del sistema. Un ejemplo son las bebidas gaseosas embotelladas.
E.1- COMBUSTIÓN
La combustión es una reacción química en la cual generalmente se desprende una gran cantidad de calor y luz.
En toda combustión existe un elemento que arde y se denomina (combustible) y otro que produce la combustión (comburente), generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado quimicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
Coches alimentados por hidrógeno, es decir, los coches llevan un depósito o tanques de hidrógeno que alimentan un motor eléctrico o bien uno de combustión (ICE). En este caso la empresa japonesa Genepax ha fabricado un coche que se abastece directamente de agua.
E.2- COMBINACIÓN DE HIDRÓGENO Y OXÍGENO
El oxigeno gaseoso se condensa formando un liquido azul pálido Fuertemente magnético. El oxigeno sólido de color azul pálido se obtiene comprimiendo el liquido. La masa atómica del oxigeno es 15,9994; a la presión atmosférica, el elemento tiene un punto de ebullición de -182,960c, un punto de fusión de -218.40c y una densidad de 1,429g/l a 00c.
El oxigeno constituye el 21% en volumen o el 23.15% en masa de la atmósfera, el 85.8% en masa de los océanos (el agua pura contiene un 88.8% de oxigeno), el 46.7% en masa de la corteza terrestre (como componente de la mayoría de las rocas y minerales). El oxigeno representa un 60.0% del cuerpo humano. Se encuentra en todos los tejidos vivos. Casi todas las plantas y animales, incluyendo los seres humanos, requieren oxígeno, ya sea en estado libre o combinado, para mantenerse con vida.
APLICACIONES DEL OXIGENO
Se usan grandes cantidades de oxigeno en sopletes para soldar a altas temperaturas, en los cuales la mezcla de oxigeno y otro gas produce una llama con una temperatura muy superior a la que se obtiene quemando gases en aire. El oxigeno se le administra a personas con problemas respiratorio y también a las que vuelan a altitudes elevadas, donde la baja concentración de oxigeno no permite la respiración normal. El aire enriquecido con oxigeno se utiliza para fabricar acero en los hornos de hogar abierto.
El oxigeno de gran pureza se utiliza en la industria de fabricación de metal. Es muy importante como liquido propulsor en los misiles teledirigidos y en los cohetes.
El hidrogeno en estado libre solo se encuentra en muy pequeñas cantidades en la atmósfera, aunque en el espacio interestelar abunda, en el sol y otras estrellas, siendo de echo el elemento mas común en el universo. En combinación con otros elemento se encuentra ampliamente distribuido en la tierra, donde el compuesto mas abundante e importante del hidrógeno es el agua. El hidrogeno se haya en todos los componentes de la materia viva y de muchos minerales. También es parte esencial de todos los hidrocarburos y de una gran variedad de otras sustancias orgánicas. Todos los ácidos contienen hidrogeno , una de las características que define a los ácidos es su disociación en una disolución, produciendo iones de hidrógeno.
El agua es un liquido inodoro e insípidos. Tiene una matriz azul, que solo puede detectarse en capas de gran profundidad. A la presión atmosférica (760mm de mercurio), el punto de congelación del agua es de 0 0c y su punto de ebullición es de m100 0c. El agua alcanza su densidad máxima a una temperatura de 40c y se expande al congelarse.
E.3- PRODUCTO DE LA REACCIONES DE NEUTRALIZACIÓN
La reacción entre un ácido y una base es una reacción de neutralización.
En una reacción de neutralización, el ácido y la base son los reactivos, y la sal y el agua, los productos:
ácido + base + sal + agua
Una reacción de neutralización es una reacción entre un ácido y una base. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Mientras que si una de las especies es de naturaleza débil se obtiene su respectiva especie conjugada y agua. Así pues, se puede decir que la neutralización es la combinación de cationes hidrógeno y de iones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal. Tambien se puede decir que esla reaccion que da lugar cuando mezclas un acido con una base de igual o diferente pH, por ejemplo: Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
Generalmente la siguiente reacción ocurre:
- ácido + base → sal + agua
Este tipo de reacciones son especialmente útiles como técnicas de análisis cuantitativo. En este caso se puede usar una solución indicadora para conocer el punto en el que se ha alcanzado la neutralización completa. Algunos indicadores son la fenolftaleína (si los elementos a neutralizar son ácido clorhídrico e hidróxido de sodio), azul de safranina, el azul de metileno, etc. Existen también métodos electroquímicos para lograr este propósito como el uso de un pHmetro o la conductimétria.
F- REACCIONES DEL AGUA
En la parte de la química que se conoce como química inorgánica, invariablemente cuando se va a investigar las propiedades de cualquier sustancia se escoge como disolvente al agua, debido a su notable capacidad para disolver electrolitos (compuestos que al entrar en solución producen iones).
Además de que muchos de los procesos de la química inorgánica serían muy lentos o prácticamente imposibles de que ocurran sin la presencia del agua, ya sea como reactivo o como disolvente.
Mucho de esto hace que el estudio de los conocimientos de su química sea de gran importancia para los químicos y debieran de serlo para la mayoría de la gente para tomar conciencia de muchas de sus acciones.
El agua es el principal e imprescindible componente del cuerpo humano. El ser humano no puede estar sin beberla más de cinco o seis días sin poner en peligro su vida.
El cuerpo humano tiene un 75 % de agua al nacer y cerca del 60 % en la edad adulta. Aproximadamente el 60 % de este agua se encuentra en el interior de las células (agua intracelular). El resto (agua extracelular) es la que circula en la sangre y baña los tejidos.
El agua puede participar en reacciones químicas como donadora o receptora de electrones, esto ocurre comúnmente en reacciones de Oxidación-Reducción.
El agua es un solvente de gran cantidad de sales inorgánicas, de compuestos orgánicos y de gases. Es la fase dispersante en el estado coloidal de la célula y la fase dispersa la forman las proteínas solubles en agua.
No se conoce a la fecha otro compuesto como el agua que posea estas propiedades a la vez. Por ejemplo, el dimetilsulfóxido posee una constante dieléctrica grande y es una buena base de Lewis pero no forma puentes de hidrógeno; el fluoruro de hidrógeno (ácido fluorhídrico) tiene una constante dieléctrica grande y forma puentes de hidrógeno pero no es buena base de Lewis; y amoníaco gaseoso es buena base de Lewis y forma puentes de hidrógeno pero no tiene una constante dieléctrica grande.
Cuando se disuelve un sólido o un líquido las unidades estructurales (iones o moléculas) se separan una de otra y el espacio entre ellas es ocupado por una molécula del solvente. Durante el proceso es necesario suministrar energía para vencer las fuerzas interiónicas o intermoleculares, la que es aportada por la formación de uniones entre partículas del soluto y moléculas del solvente.
Solamente el agua y solventes muy polares pueden disolver en cantidad apreciable compuestos iónicos, que debido a las atracciones electrostáticas forman enlaces Ion-dipolo, los cuales aportan energía suficiente para vencer las fuerzas interiónicas en el cristal. En el proceso de disolución cada Ion es rodeado por muchas moléculas del solvente (solvatación). Además un solvente para que pueda disolver a los compuestos iónicos necesita tener una constante dieléctrica muy grande, es decir, que debe tener propiedades muy aislantes para disminuir la atracción entre los iones de carga opuesta una vez que se encuentren solvatados.
El agua es un solvente muy importante de compuestos iónicos debido a su polaridad, a su elevada constante dieléctrica y a que su grupo -OH le permite formar puentes de hidrógeno. Es capaz de solvatar tanto cationes (iones con carga positiva) en su polo negativo (esencialmente sus electrones no compartidos) como aniones (iones con carga negativa) por medio de puentes de hidrógeno.
Cuando se quiere preparar una solución, es obvio que en general se busca un solvente apropiado a la naturaleza del soluto y al efecto de la temperatura sobre la solubilidad del soluto, y los demás factores que tienden a complicar al fenómeno de disolución como la solvolisis en la que las moléculas del soluto separan a las moléculas del solvente, que complican aún más la selección del solvente (solvolisis, con el agua es hidrólisis; con el amoníaco es amonolisis).
F.1- HIDRÓLISIS
Se llama así a la reacción química del agua con compuestos orgánicos o inorgánicos, que se basa en la ruptura de un enlace covalente.
Y puede describirse mediante la ecuación:
AB + HOH AH + BOH
Los compuestos reaccionantes (AB) y los productos de la hidrólisis (AH, BOH) pueden ser moléculas neutras (como en la mayoría de reacciones en que intervienen compuestos orgánicos) o iónicas (ácidos, bases o sales).
Un ejemplo de hidrólisis en compuestos orgánicos es la saponificación de un éster; las moléculas de éster se disocian en dos fragmentos, uno de los cuales reacciona con los protones H+ de la molécula disociada de agua para formar el ácido carboxílico, y la otra lo hace con los iones hidroxilo OH- para formar el alcohol:
En la mayoría de los casos, la hidrólisis de sustancias orgánicas requiere un catalizador (ácido o base). En los procesos bioquímicos, como, por Ej., la digestión, la hidrólisis de las proteínas, de los glúcidos y de los lípidos está catalizada por enzimas (hidrolasas).
Tienen importancia técnica las hidrólisis de las grasas, celulosas, proteínas, ésteres, sacarosa y almidón.
Desde el punto de vista ecológico, se destaca la hidrólisis de los herbicidas y otras sustancias nocivas como posibilidad de desintoxicación. Además, se encuentran en desarrollo procedimientos hidrolíticos para aprovechar los residuos de plásticos, madera y papel.
La meteorización química de las rocas se produce por hidrólisis, mediante la combinación de agua, sal y una base que al atacar la roca desprenden elementos con los cuales forman soluciones.
F.2- REACCIONES CON CIETOS METALES
Los metales alcalinos son metales muy reactivos, por ello se encuentran siempre en compuestos como óxidos, haluros, hidróLos metales alcalinos tienen un gran poder reductor; de hecho, muchos de ellos deben conservarse en aceite mineral o gasóleo para que su elevada reactividad no haga que reaccionen con el oxígeno o el vapor de agua atmosféricos. Son metales de baja densidad, coloreados y blandos. xidos, silicatos, etc y no en estado puro
G- HIDRATOS
Es el superlativo de agua.
Cloruro de Cobalto (II) anhidro Cocl2
En química orgánica, un hidrato es un compuesto formado por el agregado de agua o sus elementos a una molécula receptora. Por ejemplo, eletanol, C2—H5—OH, puede ser considerado un hidrato de etileno, CH2=CH2, formado por el agregado de H a un C y OH al otro C. Una molécula de agua puede ser eliminada, por ejemplo mediante la acción de ácido sulfúrico. Otro ejemplo es el hidrato de cloral, Ccl3—CH (OH)2, que puede ser obtenido mediante la reacción de agua con cloral, Ccl3—CH=O.
Otras moléculas son llamadas hidratos por razones históricas. La glucosa, C6H12O6, se pensó originalmente que respondía a la fórmula C 6 (H2O)6 y fue identificada como un carbohidrato, pero esto es una descripción de su estructura tal como se la conoce hoy en día. Por otra parte el metanol es a menudo ofrecido como “metil hidrato”, lo que implica una fórmula que es incorrecta (CH3 OH2), cuando la fórmula correcta es CH3—OH.
Cloruro de Cobalto (II) hexahidratado Co (H2O)6 Cl2
En química inorgánica, los hidratos contienen moléculas de agua que o bien están ligadas a un núcleo metálico o están cristalizadas con el complejo metálico. Tales hidratos se dice que poseen "agua de cristalización" o "agua de hidratación". Ésta es liberada cuando el hidrato es sometido a alta temperatura, la red se rompe y deja escapar una o más moléculas de agua. Si el agua es agua pesada, donde el hidrógeno consiste del isótopo deuterio, entonces se suele utilizar el término deuterar en lugar de hidratar.
G.1- SUSTANCIAS EFLORESCENTES
Diversas sales han sido encontradas en el análisis de la eflorescencia y, generalmente, son sulfatos y carbonatos de iones alcalinos (sodio y potasio) y alcalino-térreos (calcio y magnesio). Otras sales encontradas son cloruros y nitratos de los mismos iones y de otros menos frecuentes como cromo y molibdeno. En ladrillos de arcillas, de preferencia las sales son sulfatos alcalinos y en productos cementicios se producen principalmente carbonatos y sulfatos. En general, casi el 50% del contenido de estas sales dice relación con Sulfato de Sodio.
Es una Conversión espontánea en polvo de diversas sales, por perder el agua de cristalización, a causa de tener su vapor, una tensión superior a la de la atmósfera.
G.2- SUSTANCIAS HIGROSCÓPICAS
Higroscopia, palabra que deriva del griego ύγρος hygros 'húmedo, mojado' y σκοπειν skopein 'observar, mirar' es la capacidad de algunas sustancias de absorber o ceder humedad al medioambiente. También es sinónimo de higrometría, siendo esta el estudio de la humedad, sus causas y variaciones (en particular de la humedad atmosférica).
Son higroscópicos todos los compuestos que atraen agua en forma de vapor o de líquido de su ambiente, por eso a menudo son utilizados como desecantes.
Algunos de los compuestos higroscópicos reaccionan químicamente con el agua como los hidruros o los metales alcalinos. Otros la atrapan como agua de hidratación en su estructura cristalina como es el caso del sulfato de sodio. El agua también puede adsorberse físicamente. En estos dos últimos casos, la retención es reversible y el agua puede ser desorbida. En el primer caso, al haber reaccionado, no se puede recuperar de forma simple.
Algunos ejemplos de los compuestos higroscópicos más conocidos son:
- § Cloruro cálcico (CaCl2)
- § Cloruro de Sodio (Halita)(NaCl)
- § Hidróxido de Sodio (NaOH)
- § Ácido sulfúrico (H2SO4)
- § Sulfato de cobre (CuSO4)
- § Pentóxido de fósforo (P4O10)
- § Silica gel
Para cada sustancia existe una humedad que se llama de equilibrio, es decir, un contenido de humedad tal de la atmósfera a la cual el material capta humedad del ambiente a la misma velocidad que la libera. Si la humedad ambiente es menor que este valor de equilibrio, el material se secará, si la humedad ambiente es mayor, se humedecerá. Así, ciertos minerales cómo el cloruro de calcio son capaces de captar agua de la atmósfera en casi cualquier condición, porque su humedad de equilibrio es muy alta. Sustancias como estas son usadas como desecadoras. Otros ejemplos son el ácido sulfúrico, el gel de sílice, etc.
G.3- SUSTANCIAS DELICUESCENTES
Los materiales delicuescentes (del latín deliquescere, hacerse líquido) son sustancias (en su mayoría sales) que tienen una fuerte afinidad química por la humedad y que absorben cantidades relativamente altas de agua si son expuestos a la atmósfera, formando una solución líquida. Ejemplos de sustancias delicuescentes son: cloruro de calcio, férrico, cloruro , cloruro de zinc, carbonato de potasio, hidróxido de potasio y el hidróxido de sodio.
Debido a su gran afinidad por el agua, estas sustancias suelen ser usadas como desecantes.
H- PURIFICACIÓN DEL AGUA
El agua es esencial para la vida. Sin embargo, es escasa para millones de personas en todo el mundo.
¿Como purificar el agua?
Existen diferentes formas de purificar el agua, la forma mas popular de obtener agua pura es hervirla. El hervir el agua durante al menos cinco minutos bastara para matar a todos los organismos que causan enfermedades. Sin embargo, hervir el agua no es fácil. Usa mucho combustible que es a menudo caro o difícil de encontrar. Este proceso cambia el sabor del agua y necesita un tiempo para enfriarse antes de que pueda beberse. Existen otras formas para purificar el agua, las más utilizadas son:
Desinfección solar (método SODIS)
Una forma de desinfectar el agua de drenaje es el uso de radiación UV. La radiación ultra violeta es un proceso demostrado para la desinfección del agua, aire y superficies sólidas contaminadas microbiológica mente (1).
Este método se está haciendo muy popular porque es barato, simple, y requiere poco trabajo. La investigación ha demostrado que si se usa correctamente, el agua tratada es tan limpia como el agua hervida. El proceso se llama desinfección solar.
Este método requiere botellas de plástico transparentes de aproximadamente 1,5 litros (las de agua embotellada son ideales) y que el agua que no esté demasiado turbia.
Es importante no usar botellas de vidrio, ya que no permiten que entre suficiente luz solar en el agua. Las botellas de plástico tienen costados muy finos que permiten que la luz solar llegue al agua. El agua turbia debe dejarse decantar antes del uso y debe filtrarse mediante una tela o filtro de arena si todavía está turbia.
I-Peróxido de hidrógeno
El peróxido de hidrógeno (H2O2), también conocido como agua oxigenada o dioxidano es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, que por lo general se presenta como un líquido ligeramente más viscoso que éste. Es conocido por ser un poderoso oxidante.
El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9%) en muchos productos domésticos para usos medicinales y como blanqueador de vestimentas y el cabello. En la industria, el peróxido de hidrógeno se usa en concentraciones más altas para blanquear telas y pasta de papel, y al 90% como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas enzimas, como la catalasa.
I.1-Formación
Los peróxidos se forman en pequeñas dosis en muchos procesos de oxidación vegetal. Para evitar su acumulación a concentraciones dañinas los organismos suelen disponer de una enzima, la catalasa, que cataliza la Diz mutación del peróxido de hidrógeno en agua y oxígeno elemental.
I.2-Preparación
La preparación de peroxido de hidrogeno. Consiste en un proceso para la preparación de peroxido de hidrogeno por el proceso de la Antraquinona una mezcla de reacción a la cual se pasado hidrogeno a un gas contenido
Hidrogeno y una solución activa es decir un derivado de Antraquinona en un disolvente orgánico se ha circular por medio de una zona mezcladora estática alargada
Construida de varias partes al objeto de hidrogenar el derivado Antraquinona en presencia de un catalizador sólido y eliminar de la mezcla de reacción circulante .La solución activa hidrogenada y el gas se cataliza
la mezcla de reacción en un reactor tubular en el cual la mezcla de reacción se mezcla intermitentemente en una zona mezcladora estática haciéndose circular la mezcla de reacción através de las zonas mezcladoras y catalizadora a una velocidad de 0,1-1,5m/s
I.3-Propiedades fisicoquímicas
El peróxido de hidrógeno puro (H2O2) es un líquido denso y claro, con una densidad de 1,47 g/cm3 a 0 °C. El punto de fusión es de –0,4 °C, y su punto de ebullición normal es de 150 °C.
I.4-Usos
El peróxido de hidrógeno tiene muchos usos industriales, como el blanqueo de la pulpa de papel, blanqueo de algodón, blanqueo de telas y en general cada día se usa más como sustituto del cloro.
En la industria alimenticia se usa mucho para blanquear quesos, pollos, carnes, huesos, y también se usa en el proceso para la elaboración de aceites vegetales.
En la industria química se usa como reactivo, y es muy importante en la elaboración de fármacos. Se está usando también para blanqueos dentales.
El peróxido de hidrógeno se usa en la industria aeroespacial como combustible de cohetes en motores de cohete mono propelentes o como aportación de oxígeno en motores bi. propelentes. Este peróxido se usa por lo general a una concentración del 90%, y es extremadamente puro.
También se usa en concentraciones al 80% como impulsor de las turbo bombas que alimentan tanto el combustible como el oxidante en grandes motores de cohete.
Otros usos domésticos
Acuarios: el peróxido de hidrógeno (de 10 volúmenes) puede ser usado en los acuarios de peces tropicales para combatir a la Cianobacteria, la cual muere en un plazo inferior a las 12 horas desde su aplicación incorporando 15 ml/100 L de agua.
Decoloración del cabello y del vello. La desventaja es que, al realizarse esto, se produce un maltrato del cuero cabelludo, y en algunos casos se debilita causando una ligeraalopecia temporal.
A- FACTORES QUE AFECTAN LA SOLUBILIDAD Y LA VELOCIDAD DE DISOLUCIÓN
Los factores que afectan la solubilidad son:
a) Superficie de contacto: La interacción soluto-solvente aumenta cuando hay mayor superficie de contacto y el cuerpo se disuelve con más rapidez (pulverizando el soluto).
b) Agitación: Al agitar la solución se van separando las capas de disolución que se forman del soluto y nuevas moléculas del solvente continúan la disolución
c) Temperatura: Al aument6ar la temperatura se favorece el movimiento de las moléculas y hace que la energía de las partículas del sólido sea alta y puedan abandonar su superficie disolviéndose.
d) Presión: Esta influye en la solubilidad de gases y es directamente proporcional
Factores que afectan a la velocidad de disolución:
Solubilidad: a > solubilidad > velocidad
Tamaño de partícula
Polimorfismo
Grado de cristabilidad.
A.1- LAS PROPIEDADES DEL SOLUTO Y DEL DISOLVENTE
Las propiedades físicas de la solución son diferentes a las del solvente puro: la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
Sus propiedades físicas dependen de su concentración:
Disolución HCl 12 mol/L Densidad = 1,18 g/cm3
Disolución HCl 6 mol/L Densidad = 1,10 g/cm3
Propiedades de los disolventes orgánicos
Los disolventes industriales presentan.
Muchas de las propiedades importantes de las disoluciones dependen del número de partículas de soluto en la solución y no de la naturaleza de las partículas del soluto. Estas propiedades se denominan propiedades coligativas porque tienen un mismo origen; esto es, todas ellas dependen del número de partículas sean átomos, moléculas o iones.
A.2-La temperatura
La temperatura es una magnitud referida a las nociones comunes de caliente o frío. Por lo general, un objeto más "caliente”tendrá una temperatura mayor, y si fuere frío tendrá una temperatura menor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica.
La temperatura se mide con termómetros, los cuales pueden ser calibrados de acuerdo a una multitud de escalas que dan lugar a unidades de medición de la temperatura. En el Sistema Internacional de Unidades, la unidad de temperatura es el kelvin (K), y la escala correspondiente es la escala Kelvin o escala absoluta, que asocia el valor "cero kelvin" (0 K) al "cero absoluto", y se gradúa con un tamaño de grado igual al del grado Celsius.
La temperatura es una medida del calor o energía térmica de las partículas en una sustancia. Como lo que medimos en sus movimientos medio, la temperatura no depende del número de partículas en un objeto y por lo tanto no depende de su tamaño. Por ejemplo, la temperatura de un cazo de agua hirviendo es la misma que la temperatura de una olla de agua hirviendo, a pesar de que la olla sea mucho más grande y tenga millones y millones de moléculas de agua más que el cazo.
A.3- LA PRESIÓN
La presión es una magnitud física que mide la fuerza por unidad de superficie, y sirve para caracterizar como se aplica una determinada fuerza resultante sobre una superficie.
La presión parcial de un gas, en atmósferas, en una mezcla o solución sería aproximadamente la presión de dicho gas si se eliminaran repentinamente todos los demás componentes de la mezcla o solución y sin que hubiese variación de temperatura . La presión parcial de un gas en una mezcla es la medida de la actividad termodinámica de las moléculas de dicho gas y, por lo tanto, es proporcional a la temperatura y concentración del mismo.
A.4- TAMAÑO DE PARTÍCULA
¿Qué son las partículas?
Existen cosas flotando en el aire. La mayoría de ellas no pueden ser vistas. Estas cosas flotantes son un tipo de contaminación del aire llamadas partículas. De hecho, las partículas pueden ser lo que más comúnmente afecte la salud de las personas.
Las partículas pueden existir en cualquier forma, tamaño y pueden ser partículas sólidas o gotas líquidas. Dividimos a las partículas en dos grupos principales. Estos grupos difieren en varias formas. Una de las diferencias es el tamaño. A las más grandes las llamamos PM10 y las más pequeñas les llamamos PM2.5.
Grandes: Las partículas grandes miden entre 2.5 y 10 micrómetros ( de 25 a 100 veces más delgados que un cabello humano). Estas partículas son llamadas PM10 (decimos PM diez, el cual significa partículas de hasta 10 micrómetros en tamaño). Estas partículas causan efectos menos severos para la salud.
Pequeñas: Las partículas pequeñas son menores a 2.5 micrómetros (100veces mas delgadas que un cabello humano) . Estas partículas son conocidas como PM 2.5 (decimos PM dos punto cinco, como en partículas de hasta 2.5micrometros en tamaño).
De donde provienen las partículas….
El tamaño no es la única diferencia. Cada tipo de partículas están hechas de diferente material y provienen de diferentes lugares.
A.5-VELOCIDAD DE AGITACIÓN DE LAS PARTICULAS
Toda la materia está formada por partículas en continua agitación: Incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente.
Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En esta animación puedes ver las moléculas de un gas en continua agitación.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
B- TIPOS DE DISOLUCIONES DE ACUERDO AL ESTADO FÍSICO DEL SOLUTO
- Gas en líquido
- Un líquido en líquido
B.1- GAS EN LÍQUIDO
: Por ejemplo, Oxígeno en Agua
B.2-Líquidos en Líquidos
Ésta es otra de las disoluciones más utilizadas. En prácticas de química por ejemplo, se han realizado mezclas de Alcohol con Agua para comprobar su densidad; después de mezclarlas, un método para volverlas a separar es por destilación.
AB.3-Sólidos en Líquidos
Este tipo de disoluciones es de las más utilizadas, pues se disuelven por lo general pequeñas cantidades de sustancias sólidas (solutos) en grandes cantidades líquidas (solventes). Ejemplos claros de este tipo son la mezcla del Agua con el Azúcar, también cuando se prepara un Té, o al agregar Sal a la hora de cocinar
C- TIPOS DE DISOLUCIONES DE ACUERDO A LA CANTIDAD DEL SOLUTO PRESENTE
C.1- DISOLUCIONES SATURADAS
Tienen la mayor cantidad posible de soluto para una temperatura y presión dadas. En ellas existe un equilibrio entre el soluto y el solvente.
C.2-Disolución no-saturada
es aquella en donde la fase dispersa y la dispersante no están en equilibrio a una temperatura dada; es decir, ellas pueden admitir más soluto hasta alcanzar su grado de saturación.
Ej: a 0 ºC 100 g de agua disuelven 37,5 NaCl, es decir, a la temperatura dada, una disolución que contengan 20g NaCl en 100g de agua, es no saturada.
C.3-Disolución sobresaturada
contiene más soluto del que puede existir en equilibrio a una temperatura y presión dadas. Si se calienta una solución saturada se le puede agregar más soluto; si esta solución es enfriada lentamente y no se le perturba, puede retener un exceso de soluto pasando a ser una solución sobresaturada. Sin embargo, son sistemas inestables, con cualquier perturbación el soluto en exceso precipita y la solución queda saturada.
D- CONCENTRACIÓN DE LAS DISOLUCIONES
En química, la concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada es ésta.
Que la agitemos. Entonces, la disolución estará saturada, y la sal que le agreguemos, en vez de disolverse se precipitará al fondo del vaso. Si calentamos el agua, ésta podrá disolver más sal (aumentará la solubilidad de la sal en el agua), y si la enfriamos, el agua tendrá menos capacidad para retener disuelta la sal, y el exceso se precipitará.
D.1- PORCENTAJE REFERIDO A LA MASA
Se define como la masa de soluto (sustancia que se disuelve) por cada 100 unidades de masa de la disolución:
Por ejemplo, si se disuelven 20 g de azúcar en 80 g de agua, el porcentaje en masa será: 20/(80+20)x 100=20% o, para distinguirlo de otros porcentajes, 20% m/m
D.2- PARTES POR MILLÓN
Es una unidad de medida que se refiere a los mg (miligramos) que hay en un kg de disolución; como la densidad del agua es 1, 1 kg de solución tiene un volumen de aproximadamente 1 litro, los ppm son también los mg de una sustancia en un litro expresado de otra forma, mg/l (Siguiendo el mismo razonamiento, los ppm también son los gramos que contiene cada metro cúbico, g/m³) Para calcular los ppm se divide el peso en mg por el volumen en litros. Su símbolo es ppm.
D.3- MOLARIDAD
La molaridad (M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una disolución de esta concentración habitualmente se disuelve primero el soluto en un volumen menor, por ejemplo 300 mL, y se traslada esa disolución a un matraz aforado, para después enrasarlo con más disolvente hasta los 1000 mL.
Es el método más común de expresar la concentración en química, sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, este proceso tiene el inconveniente de que el volumen cambia con la temperatura.
Se representa también como: M = n / V, en donde "n" son los moles de soluto(n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
D.4- NORMALIDAD
La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución.
El número de equivalentes se calcula dividiendo la masa total por la masa de un equivalente: n = m / meq, o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar: .
D.4.1- RELCIÓN DE MOLARIDAD A NORMALIDAD (FACTOR DE CONVERSIÓN)
D.5- MOLALIDAD
La molalidad (m) es el número de moles de soluto por kilogramo de disolvente (no de disolución). Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión.
Es menos empleada que la molaridad pero igual de importante.
E- PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES
En química, se llaman propiedades coligativas aquellas propiedades de una solución que dependen únicamente de la concentración molal, es decir, de la cantidad de partículas de soluto por partículas totales, y no de la naturaleza o tipo de soluto. Están estrechamente relacionadas con la presión de vapor, que es la presión que ejerce la fase de vapor sobre la fase líquida, cuando el líquido se encuentra en un recipiente cerrado
E.1- ELEVACIÓN DEL PUNTO DE EBULLICIÓN
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido.1En esas condiciones se puede formar vapor en cualquier punto del líquido.
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente - dipolo permanente, dipolo inducido - dipolo inducido o puentes de hidrógeno)
Cálculos del punto de ebullición
El punto de ebullición normal puede ser calculado mediante la fórmula de Clausius-Clapeyron:
|
donde:
|
|
|
TB
|
=Punto de ebullición normal en grados Kelvin
|
|
R
|
= Constante ideal del gas, 8,314 J · K-1 · mol-1
|
|
P0
|
= Presión del vapor a una temperatura dada, en atmósferas (atm)
|
|
ΔHvap
|
= Calor de vaporización del líquido, J/mol
|
|
T0
|
= La temperatura dada en grados Kelvin
|
|
ln
|
= Logaritmo natural en base e
|
E.2- ABATIMIENTO DEL PUNTO DE CONGELACIÓN
En soluciones formadas por solutos no volátiles se observa un descenso de la temperatura de congelación, respecto a la del solvente puro. Esta disminución es proporcional a la concentración molal de la solución y se relaciona por medio de la constante crioscópica molal, que se expresa en °C/m y depende de la naturaleza del solvente. La expresión matemática es:
E.3- DETERMINACIÓN DE LA MASA MOLAR Y LA MASA MOLECULAR
La masa molar (símbolo M) de un átomo o una molécula es la masa de un mol de dicha partícula expresada en gramos. Es una propiedad física característica de cada sustancia pura. Sus unidades en química son g/mol.
Esta magnitud tiene el mismo valor numérico que la masa molecular de dicha partícula, pero en vez de estar en unidad de masa atómica está en gramos/mol. La masa molar está relacionada con el peso molecular o masa molar relativa (Mr) de un compuesto, con las masas atómicas relativas o pesos atómicos estándar de los elementos constituyentes. Sin embargo, debe ser distinguida de la masa molecular, que es la masa de una molécula (de cualquier composición isotópica) y no está directamente relacionada con la masa atómica, que es la masa de un átomo (de cualquier composición isotópica). El Dalton, símbolo Da, también es utilizado como unidad de masa molar, especialmente en bioquímica, y se define 1 Da = 1 g/mol, a pesar del hecho de ser estrictamente una unidad de masa molecular (1 Da = 1×10–27 kg). Las masas molares casi nunca son medidas directamente. Pueden ser calculadas a partir de los pesos atómicos estándar y están usualmente listadas en catálogos químicos y en la Ficha de datos de seguridad (FDS). Las masas molares varían típicamente entre:
- 1–238 g/mol para átomos de elementos de ocurrencia natural
- 10–1.000 g/mol para compuestos químicos sencillos
- 1.000–5.000.000 g/mol para polímeros, proteínas, fragmentos de ADN, etc.
Masa Molar=Nºde Avogadro x Peso atómico.
a masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Su unidad es elDalton o unidad de masa atómica, que se abrevia u (antes uma).
La masa molecular se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia. A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular. La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso de la molécula de agua, H2O, su masa molecular sería:
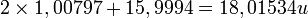
(masa atómica del H: 1,00797, masa atómica del O: 15,9994)
Se multiplica por 2, ya que la molécula de agua contiene 2 átomos de hidrógeno (H).
Cuando un haz de luz pasa a través de un coloide, las partículas dispersas difractan la luz, haciendo que se forme un rayo de luz angosto, dentro del cual es posible observar pequeñas manchas luminosas, que corresponden a la luz reflejada sobre la superficie de las partículas coloidales. Esto no ocurre en solucione verdaderas, pues las partículas de soluto son demasiado pequeñas como para desviar la luz. Este fenómeno recibe el nombre de efecto óptico o efecto Tyndall, en honor a su descubridor.
B- EFECTO DE MOVIMIENTO
En una solución verdadera las moléculas están siempre en rápido movimiento. Tanto las moléculas de soluto como las de solvente presentan movimiento molecular. Como las partículas coloidales son grandes, por lo general formadas por agregados moleculares, su movimiento es más lento. Aparentemente la causa del movimiento de las partículas coloidales es el bombardeo que reciben de las moléculas del medio en el cual están dispersas. Robert Brown (1777-1858) fue el primero que observó, en el ultramicroscopio, este movimiento es una de las razones por las que las partículas coloidales no se sedimentan, a pesar de su gran tamaño, aun cuando se dejen en reposo por un tiempo prolongado.
C- EFECTO DE CARGA ELÉCTRICA
- Efecto calorífico. Los hilos conductores se calientan al pasar por ellos la corriente eléctrica. Este efecto se aprovecha en radiadores, cocinas eléctricas y, en general, en todos los electrodomésticos utilizados como sistemas de calefacción. Sin embargo, este efecto tiene también consecuencias negativas, puesto que, al calentarse, los hilos disipan energía. En una bombilla de incandescencia esto eleva el consumo energético.
- Efecto químico. La corriente eléctrica puede inducir cambios químicos en las sustancias. Esto se aprovecha en una pila, que produce electricidad a partir de cambios químicos, o engalvanotecnia, la técnica empleada para recubrir de metal una pieza.
- Efecto luminoso. En una lámpara fluorescente, el paso de corriente produce luz.
- Efecto magnético (electromagnetismo). Es el más importante desde el punto de vista tecnológico. Una corriente eléctrica tiene efectos magnéticos (es capaz de atraer o repeler un imán). Por otra parte, el movimiento relativo entre un imán y una bobina (un hilo metálico arrollado) se aprovecha en las máquinas eléctricas para producir movimiento o para generar electricidad.
D- EFECTO DE ABSORCIÓN
La adsorción es un proceso por el cual átomos, iones o moléculas son atrapadas o retenidas en la superficie de un material, en contraposición a la absorción, que es un fenómeno de volumen.
En química, la adsorción de una sustancia es su acumulación en una determinada superficie interfacial entre dos fases. El resultado es la formación de una película líquida o gaseosa en la superficie de un cuerpo sólido o líquido.
Considérese una superficie limpia expuesta a una atmósfera gaseosa. En el interior del material, todos los enlaces químicos (ya sean iónicos, covalentes o metálicos) de los átomosconstituyentes están satisfechos. En cambio, por definición la superficie representa una discontinuidad de esos enlaces. Para esos enlaces incompletos, es energéticamente favorable el reaccionar con lo que se encuentre disponible, y por ello se produce de forma espontánea.
La naturaleza exacta del enlace depende de las particularidades de los especímenes implicados, pero el material adsorbido es generalmente clasificado como fisisorbido o quimisorbido.
La cantidad de material que se acumula depende del equilibrio dinámico que se alcanza entre la tasa a la cual el material se adsorbe a la superficie y la tasa a la cual se evapora, y que normalmente dependen de forma importante de la temperatura. Cuanto mayor sea la tasa de adsorción y menor la de desorción, mayor será la fracción de la superficie disponible que será cubierta por material adsorbido en el equilibrio.
Para estos procesos, resultan interesantes materiales con una gran superficie interna, (y por lo tanto poco volumen) ya sea en polvo o granular, como el carbón activo, y llevan asociados otros fenómenos de transporte de material, como el macro transporte y micro transporte de los reactivos.
|
|
Hoy habia 2 visitantes (6 clics a subpáginas) ¡Aqui en esta página!
|
|
 |
|